
“ 理解纳米材料与生物系统之间的相互作用对于提高纳米药物的有效性和加深对生物领域的理解起着至关重要的作用。荧光显微镜是一种强大的光学成像技术,可以直接观察细胞内微环境中荧光标记纳米材料的行为。然而,传统的荧光显微镜,如共聚焦显微镜,由于光的衍射而具有有限的光学分辨率,因此无法提供直径小于 250 nm 的纳米材料的精确细节。幸运的是,超分辨率荧光显微镜的发展克服了分辨率的限制,能够对纳米细胞相互作用进行更全面的研究。在此,我们总结了通过各种超分辨率显微技术研究的纳米细胞相互作用的最新进展。”
为了充分了解纳米材料与细胞内结构域的相互作用,必须更详细地了解物理化学特性在决定纳米材料的细胞结合、内化、加工和细胞内命运中的作用,这需要具有更高质量的多色成像技术。因此,需要能够克服荧光显微镜光学分辨率限制的新方法。在过去的几十年里,超分辨率荧光显微镜或突破衍射极限的荧光显微镜已经被开发出来,允许以超出衍射极限的更高分辨率捕获图像,分辨率能达到5 nm左右。特别是,在2014 年 10 月 8 日,诺贝尔化学奖授予Eric Betzig,William. E. Moerner和Stefan W. Hell的“超分辨荧光显微镜的发展”,将“光学显微镜带入纳米维度”,填补了电子显微镜和荧光显微镜的空白。

《Advances in super-resolution fluorescence microscopy for the study of nano–cell interactions》
01研究结果
1、超分辨率显微镜分类
超分辨率显微镜可大致分为两大类:“真正的”超分辨率技术捕捉倏逝波中包含的信息并直接给出超分辨率图像;和“功能性”超分辨率技术,使用智能实验技术和对被成像样本的已知限制来重建和产生确定性(利用非线性荧光团的响应)或随机(利用荧光团的复杂时间行为)超分辨率图像。超分辨率方法也可以通过三个著名的家族来识别,如图 1 所示,包括(i)“结构化照明”SIM (ii) “受激发射损耗”方法STED;和(iii) “单分子定位”方法,其中单个荧光分子按顺序定位,并以采集亮点方式重建图像。其中SIM、STED、STORM、PALM、PAINT等多种超分辨率技术已成功应用于生物领域。
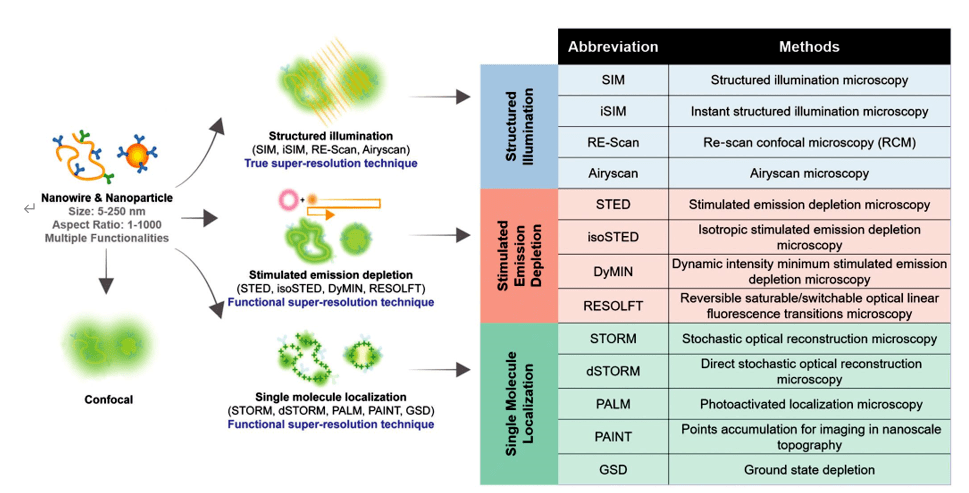
图1. 超分辨率方法目录及其用于观察纳米材料的代表性机制的说明,包括结构化照明、受激发射损耗和单分子定位
2、使用超分辨率荧光显微镜研究纳米生物相互作用
2.1 结构照明显微镜(SIM)
SIM 是一种超分辨率荧光显微镜方法,它通过利用莫尔条纹来提高空间分辨率,该莫尔条纹包含在观察区域中编码的其他无法观察的结构信息。使用特定的光栅在不同角度形成衍射图案,从而产生包含附加信息的莫尔图案(图 1)。因此,当使用这些多个光栅角度(三个以上不同的角度)时,可以从样本中提取大约两倍的信息量。该信息可用于以数学方式重建超分辨率图像,其横向分辨率为 110 nm,轴向分辨率为 250 nm。即时 SIM 和非线性 SIM 等方法已经能够实现 50 nm 的空间分辨率。SIM广泛用于纳米生物相互作用研究,由于其以每个颜色通道超过 10 Hz 的帧速率进行快速成像采集。SIM 增强的分辨率增加了纳米材料与图像中观察到的细胞内细胞器的共定位信号。
使用共聚焦显微镜和 SIM 检测 HeLa 细胞中的金属氧化物纳米粒子。他们表明,当使用 SIM 成像时,通过共聚焦显微镜获得的图像中似乎是纳米颗粒和溶酶体共定位的一些区域被证明不是真正的共定位。纳米颗粒可能包含在其他膜结合结构(例如,内体)中(图 2i)。在这种情况下,SIM 能够更准确地识别与溶酶体共定位的纳米颗粒,这有助于纳米药物载体设计,该载体设计结合了 pH 触发的药物释放,以实现精确的治疗有效载荷递送。
图2. SIM 研究的纳米细胞相互作用,包括纳米颗粒的共定位、纳米胶囊的细胞内变形和内化纳米胶囊的量化
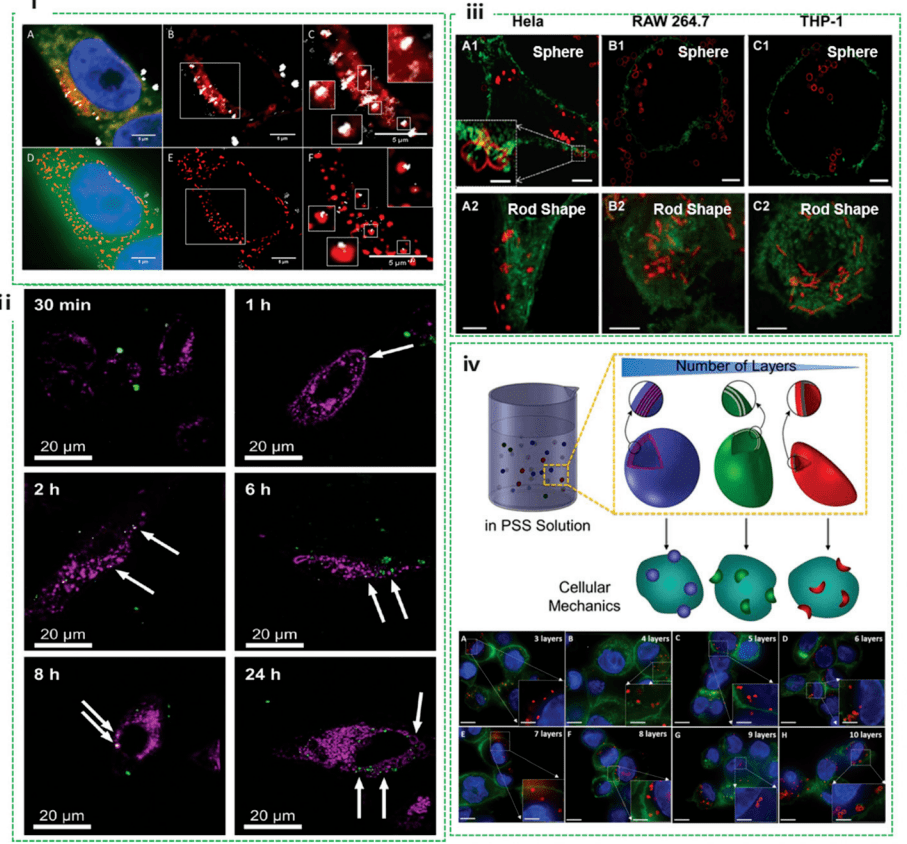
研究人员 通过使用 SIM,在 24 小时内捕获金属有机框架 (MOF) 进入 HeLa 细胞的过程。结果表明,由于细胞内和细胞外空间之间的介质差异,细胞外空间中的 MOF 比位于细胞内的 MOF 移动得更快(图 2ii)。进一步研究发现,MOFs 吸收到 HeLa 细胞中既不受药物模型(钙黄绿素)加载的影响,也不受温度处理过程的影响。纳米粒子在内化过程中的变形特性提供了对其稳定性和细胞内潜在作用机制的深入了解。然而,使用传统的共聚焦显微镜,在与生物系统相互作用时确定纳米结构形态的细微变化通常具有挑战性。 学者们探索了 SIM 以研究各种细胞系中聚合物胶囊的细胞内变形。据观察,胶囊的变形取决于细胞系(图 2iii),包括 HeLa、Raw264.7 和不同的 THP-1,但与胶囊的形状(球体和棒状)无关。这表明机械力因细胞系而异,因为 HeLa 中发生的变形百分比最高,其次是 RAW264.7 和分化的 THP-1 细胞。此外,他们精确量化了用聚合物纳米胶囊区分 THP-1 细胞的细胞内化机制。 在细胞内化过程中施加在胶囊上的压力通过评估 SIM 可视化的胶囊变形程度来量化(图 2iv)。这项开创性工作为检测细胞力学提供了一种实用的方法,这对于揭示细胞力学生物学和设计对细胞机械力敏感的先进材料具有重要意义。
2.2 受激发射损耗显微镜(STED)
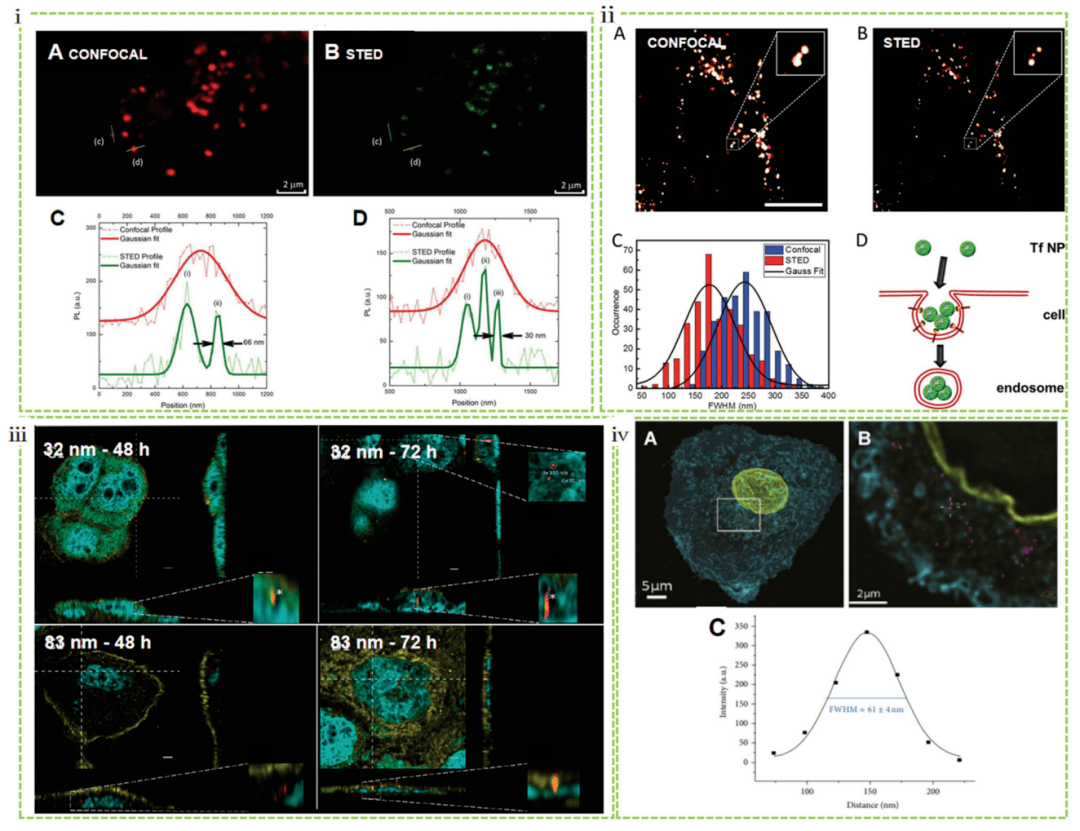
STED 耗尽点扩散函数外部区域的荧光团以锐化焦点,因此将横向和轴向的分辨率提高到 25-80 nm(图 1)。与SIM、STED 允许更高的分辨率,不需要后数学处理,具有实时成像和快速采集的能力。例如,STED 显微镜成功地用于对固定和活的 MCF7 细胞中碳点的定位进行成像,与传统的共聚焦显微镜相比,空间分辨率提高了 6 倍以上,低至 30 nm(图 3i)。同样,STED 也被应用于成像活细胞与转铁蛋白的相互作 用。与共焦图像相比,纳米粒子具有大约 4 倍的分辨率增强。这种 STED 不仅能够对活细胞中这些基于蛋白质的结构进行精确成像,而且还揭示了早期内体结构内化后颗粒的富集(图 3ii)。Kraegeloh 的小组首先应用 STED 来研究纳米粒子与细胞的相互作用。他们使用 STED 确定了人结肠癌细胞 (Caco-2) 内荧光二氧化硅颗粒(直径为 32 和 83 nm)的团聚体尺寸。与 83 nm 粒子相比,32 nm 粒子迁移的定量评估表明,更多的 32 nm 粒子被内化,并且它们迁移到细胞中的速度更快。只有 32 nm 的颗粒穿透细胞核并在 48 小时后形成 200 nm 的附聚物,72 小时后在核中形成 300 nm 的附聚物(图 3iii)。这项工作为研究纳米材料的多向性相互作用开辟了一条途径。Kraegeloh 的小组首次进一步证明,可以通过图像处理从整个细胞的 3D STED 图像堆栈中提取肺上皮细胞 (A549) 内化的二氧化硅纳米粒子数量的定量估计。STED 图像在 A549 细胞摄入于直径为 25 nm 的纳米粒子5 小时后进行拍摄(图 3iv)。
图 3 STED 研究的纳米细胞相互作用,包括纳米颗粒的内吞作用机制和内化量化
2.3 随机光学重建显微镜(STORM)
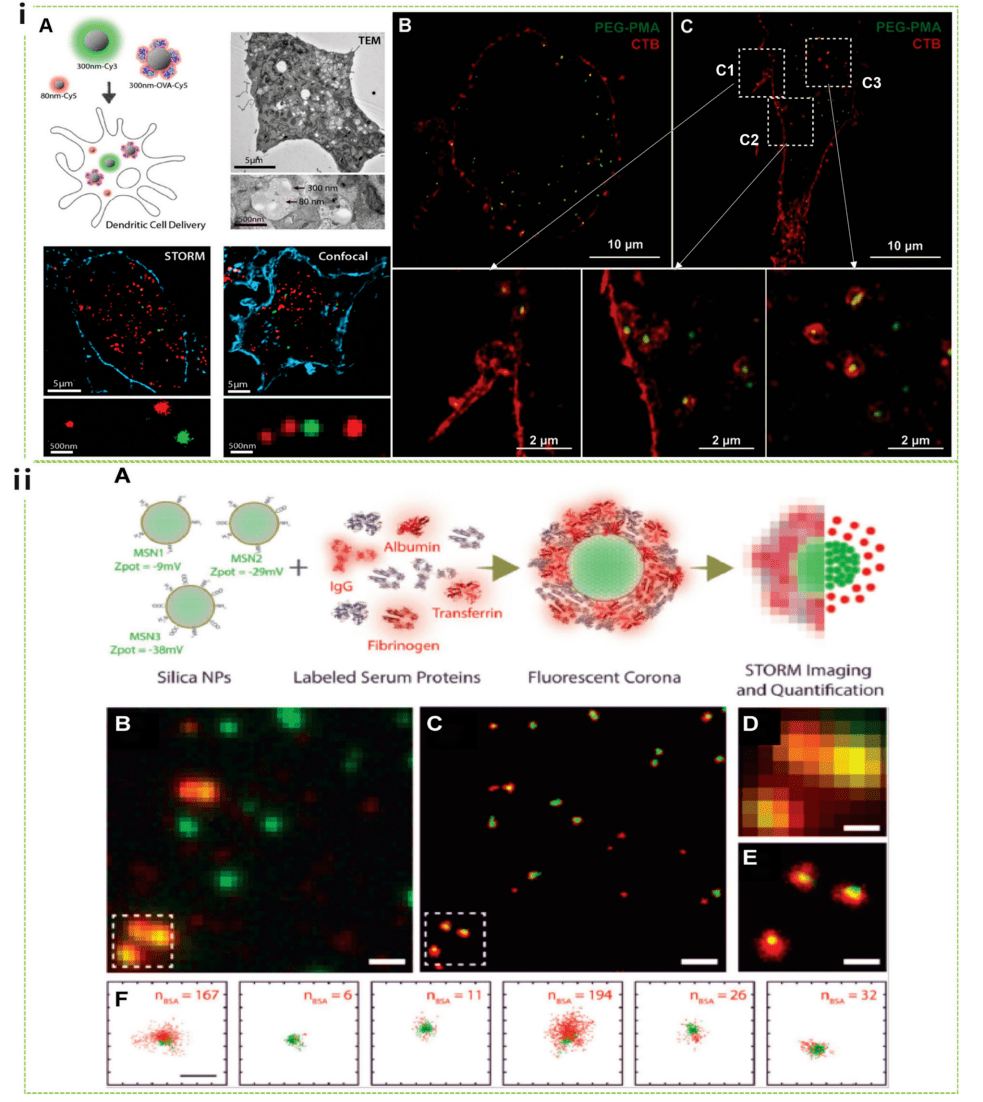
STORM 基于对单个随机闪烁荧光团的准确定位,可以提供高分辨率图像,分辨率比标准荧光显微镜高 数十倍。STORM 已经成功在生物学研究中完全用于发现未揭示的细胞结构。De Geest 和 Albertazzi 将 STORM 与单分子数据分析相结合,探索纳米粒子进入细胞过程中的行为,提供对纳米粒子相互作用的定量研究与细胞膜和随后的吸收机制有关。值得注意的是,他们直接比较了使用 TEM、STORM 和共聚焦显微镜获得的细胞内纳米粒子的图像(图 4i)。STORM 最近还被用于纳米生物相互作用的定量体外研究,其中研究人员研究了围绕纳米颗粒的蛋白冠的形成如何影响注射纳米颗粒的稳定性、靶向能力和免疫原性,以发挥其治疗潜力。Albertazzi 的小组证明,MSN 之间表面化学的细微初始差异可以导致异质蛋白质扩增粒子的多样性,导致具有不同蛋白质层和不同理化性质的粒子共存(图 4ii)。
图4 STORM 研究的纳米细胞相互作用,包括摄取机制和蛋白冠的形成
2.4 光活化定位显微镜(PALM)
PALM 利用光开关荧光蛋白来激活分子亚群以进行随机顺序单分子识别。活细胞 PALM 的一个有前途的应用是使用光活化来执行高密度单粒子跟踪,克服了单粒子跟踪的传统限制,以与显示非常低浓度荧光团的系统一起工作。通过使用 PALM 结合单粒子追踪,研究了聚苯乙烯基纳米粒子内吞的动态内吞过程,这允许在活细胞环境中可视化网格蛋白介导的纳米粒子内吞作用。结果表明,在大多数事件中,>90% 的纳米颗粒首先与细胞膜结合,随后形成了氯氰菊酯涂层的小坑 (CCP),而其余的纳米颗粒则在细胞膜内扩散以供利用由预制的 CCP。
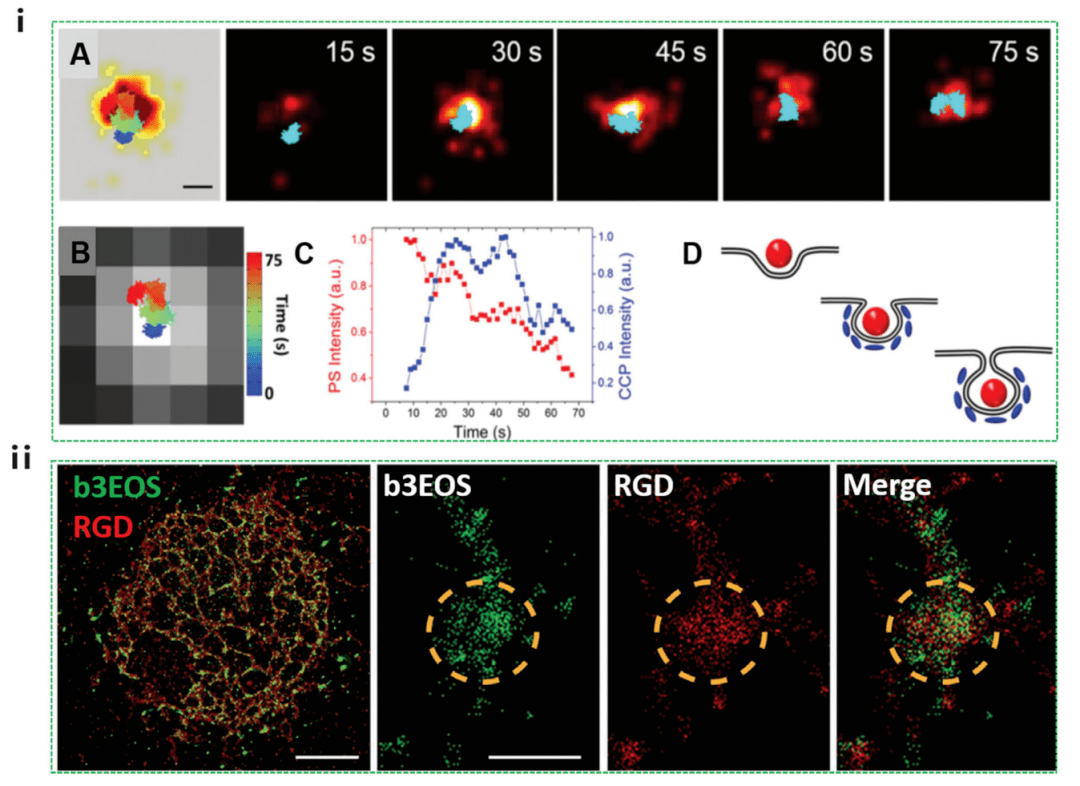
图 5 PALM 研究的纳米细胞相互作用,包括细胞摄取过程和细胞内定位
如图 5i 所示,纳米颗粒(红色)首先粘附在质膜上,而网格蛋白(蓝色)不可见。 然后,CCP 信号逐渐增强,表明 cla-thrin 向该站点募集。 在这 55 ± 23 秒的持续时间内,纳米粒子的发射强度基本保持不变。 CCP 信号达到峰值后,纳米颗粒强度开始降低。 在后期(45-75 秒),在 CCP 的 PALM 图像和纳米粒子轨迹中都观察到了 100 nm 的横向运动,这可能是由于纳米粒子在胞内区。 虽然这项工作只关注网格蛋白介导的内吞作用,但它为研究 PALM 纳米颗粒的其他内吞作用机制开辟了一条途径。 PALM 还被用来表征和量化 10 nm 分辨率下不同刚度的 RGD 矩阵上的早期整合素簇(图 5ii)。 结果表明,非常早期的粘连由 50 个 β3 激活的整联蛋白的 100 nm 簇组成。 这些早期的粘连形成类似地在柔性和刚性基材上,但是大多数粘附在刚性基材上是暂时的。
02研究总结
过去的十年中,随着超分辨率技术的整合,纳米细胞相互作用中的光学显微镜领域经历了复兴。尽管仍然存在一些担忧,超分辨率显微镜与其他荧光显微镜技术一样,依赖于细胞内荧光分子的表达,通常是通过引入可直接影响细胞生理的外部基因,因此可能无法反映“真实”的纳米细胞相互作用,毫无疑问,超分辨率技术的发展代表了一项重大进步,也是了解纳米材料在生物领域之旅中的行为的有力工具。
以纳米分辨率直接可视化纳米材料的能力产生了关键信息,例如单个内吞事件的机制、细胞内纳米粒子的追踪以及治疗有效载荷的细胞内位置。必须了解这些作用机制,才能设计出具有增强内化效率和跟踪动力学的安全纳米粒子。反过来,此类信息可用于加深对生物环境的基本了解。随着超分辨率显微镜技术(例如更好的探测器和荧光探针)的不断发展,我们已经看到该方法在空间和时间分辨率、复杂标本的可访问性和生命系统的微创性方面的性能显着提高。这将为研究纳米细胞相互作用提供更多机会。
在本研究中, 这项2014年诺贝尔化学奖的发现已在国内实现产业化。 宁波 威斯尼斯人wns888入口科技 有限公司 (INVIEW) 现已发布超高分辨率显微系统 iSTORM ,采用3D随机光学重构技术、高精度细胞实时锁定技术、多通道同时成像技术等,以 纳米级观测精度 、 高稳定性 、 广泛环境适用 、 快速成像 、 简易操作 等优异特性,获得了超过50家科研小组和100多位科研人员的高度认可。
参考文献:
1. Advances in super-resolution fluorescence microscopy for the study of nano–cell interactions
威斯尼斯人wns888入口:
威斯尼斯人wns888入口(INVIEW)是专业从事超高分辨率显微技术和产品研发的科技企业,依托复旦大学的自动控制、新一代信息技术及香港科技大学的生物、光学、图像处理等的技术,拥有光学、生物、自控、机械、信息技术等多领域交叉学科技术团队,将2014年诺贝尔化学奖技术产业化,推出了超高分辨率显微产品,帮助人们以前所未有的视角观察微观世界,突破极限,见所未见。



